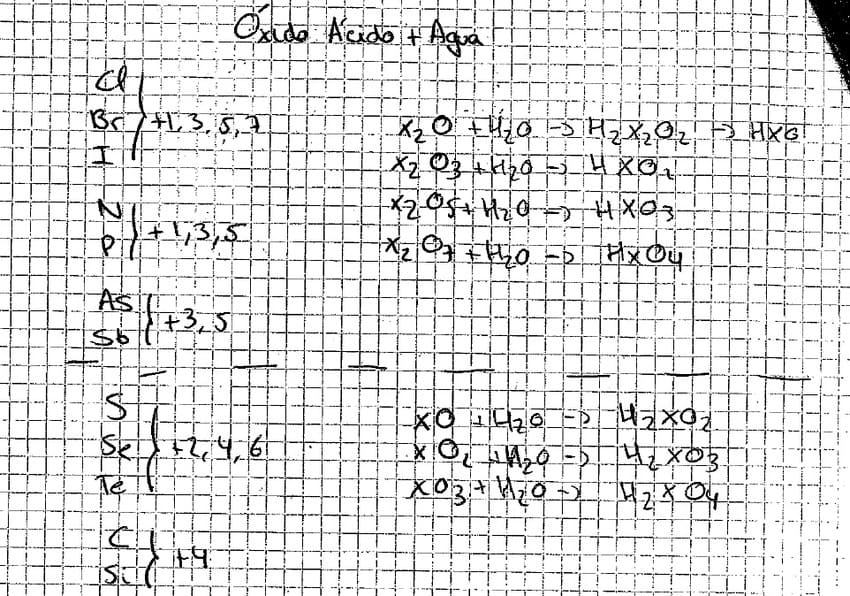Ejercicios Formulación Inorgánica Repaso 1º Bachillerato
Ejercicios resueltos de formulación y nomenclatura de los compuestos químicos inorgánicos, exámenes corregidos con soluciones de 1º de Bachiller , de repaso y de recuperación de 2º de Bachiller.
Formulación inorgánica Rápida.
Errores que no debes cometer y trucos para formular rápido y bien.
- En la primera sección, tienes exámenes resueltos y corregidos de formulación inorgánica en imágenes.
- En la segunda, tienes las tablas de la valencias de los elementos químicos metales y no metales.
- En la tercera, tienes una guía de formulación rápida de compuestos inorgánicos, con ejercicios y ejemplos resueltos desde 1º a 2º de Bachiller.
▶ Exámenes Corregidos de Formulación Inorgánica Bachiller Repaso
Imágenes de exámenes escaneados de primero de bachillerato: nomenclatura y formulación de compuestos inorgánicos.
Examen 1 Bachiller Formulación Inorgánica con Soluciones
Examen Formulación Inorgánica Recuperación 2º Bachiller
Examen de nomenclatura de ácidos y sales
Dnota10 esta destinado a proporcionar ejercicios y exámenes de química de segundo de bachillerato para aprobar la selectividad de química.
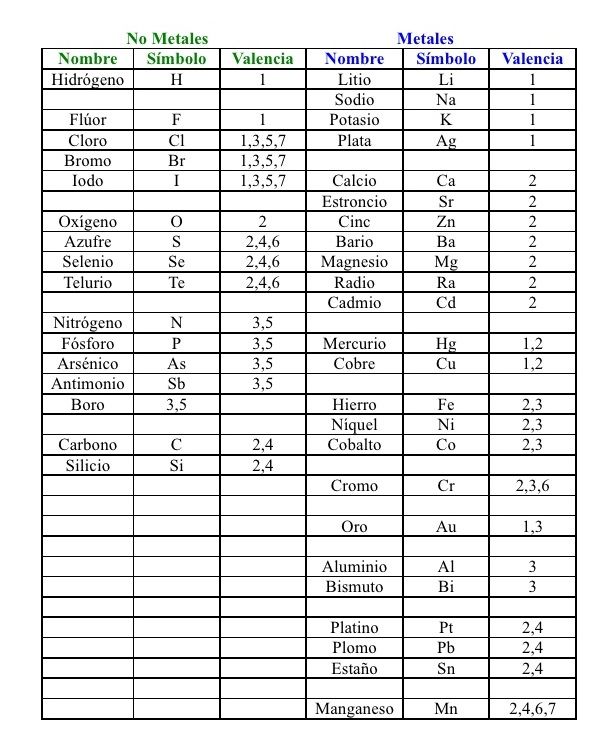
▶ Tabla de Valencias Metales y No Metales para Formulación Inorgánica
Tablas de valencia de los elementos químicos metales y los no metales en imágenes.
Imagen de la Tabla de Valencia de los Metales:
Imagen de la Tabla de Valencia de los No Metales
▶ Guía rápida de Formulación Inorgánica de Bachillerato Fácil
Lo primero que tienes que saber para aprender formulación inorgánica rápido, es que las nomenclaturas para nombrar las compuestos son:
- Nomenclatura tradicional
- Nomenclatura stock
- Nomenclatura sistemática
Vamos a explicar la formulación de óxidos, anhídridos, hidruros, sales neutras, sales acidas, hidróxidos y peróxidos.
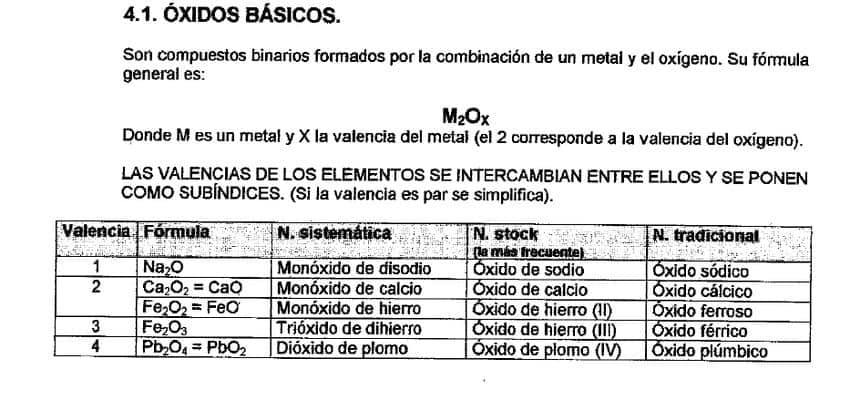
Formulación Inorgánica de Óxidos y Anhídridos
Los anhídridos son muy importantes ya que son la base para formular los ácidos que aparecen continuamente en el temario de química de 2º de bachiller, en temas como redox, equilibrio y ácido base.
Ambos, óxidos y anhídridos contienen el grupo oxigeno que se coloca al final. La diferencia entre óxidos y anhídridos es que en los óxidos se combina un metal con el oxígeno y en los anhídridos es el no metal el que hace el enlace con el oxígeno.
El oxígeno siempre pasa al otro elementos un 2, es decir, tiene como valencia el número dos.
Nomenclatura sistemática Formulación Óxidos:
Es la más sencilla ya que únicamente tienes que preocuparte de nombrar lo que ves utilizando los prefijos di, tri, tetra, penta...y en el orden que está escrito el compuesto.

Nomenclatura stock Formulación Óxidos:
En la nomenclatura stock sí que tienes que fijarte en que valencia ha pasado cada elemento, ya que esta valencia se coloca entre paréntesis y en números romanos.
En la nomenclatura de stock solo tienes que indicar la valencia de aquellos elementos que tengan dos o más valencias.
El sodio solo tiene una única valencia que es el número 1, con lo cual no se indica.
Sin embargo, el hierro tiene las valencias 2 y 3. En este caso sí que hay que indicar con paréntesis la que esta utilizando en el compuesto que tienes que nombrar.
Nomenclatura Tradicional Óxidos y Anhídridos:
Es la que más se utiliza, aunque es la más complicada. Los elementos que tienen dos valencias se nombran con los sufijos –oso para la menor e –ico para la mayor.
En el caso de tres valencias, como el azufre, la más pequeña se nombra con el prefijo hipo- y el sufijo –oso.
La valencia intermedia con el sufijo –oso y la última con el sufijo –ico
En el caso de elementos con cuatro valencias, se procede igual que el caso anterior salvo que la más pequeña de todas se nombra con el prefijo per- y el sufijo –ico.
Así tendríamos: anhídrido hipocloroso, anhídrido cloroso, anhídrido clórico y anhídrido perclórico.
Ejemplos Formulación Inorgánica Óxidos
Ejemplos Formulación Inorgánica Anhídridos
Truco de Formulación Inorgánica
Cuidado con el anhídrido de nitrógeno y con el oxido nítrico que siempre entra en los exámenes y lleva a confusiones.
¡Apréndetelo de memoria!
Ejercicios Nomenclatura Óxidos y Anhídridos
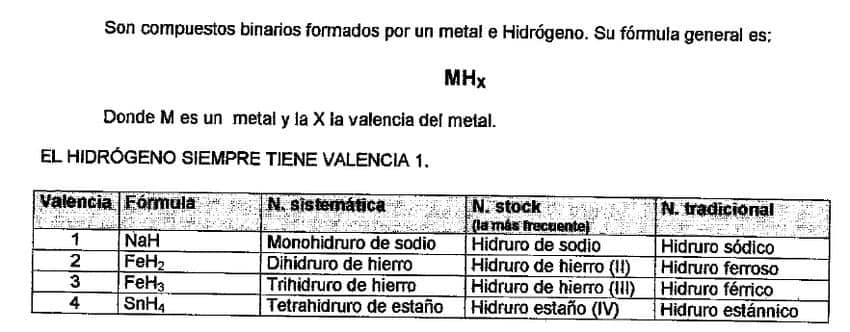
Formulación Inorgánica Hidruros
Similar al caso anterior, el hidrogeno se coloca al final y pasa la valencia 1. (En realidad es -1 pero por ahora no voy a entrar en esto que no te quiero liar). Con lo que te tienes que quedar es que pasa un 1.
Ejemplos de Formulación y Nomenclatura de Hidruro Metálicos
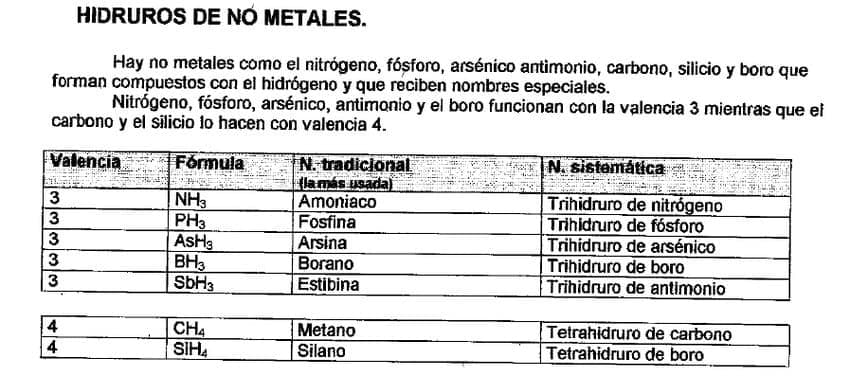
El hidrógeno se puede combinar con metales dando como resultado hidruros metálicos o con no metales dando en este caso hidruros no metálicos.
Dentro de los hidruros no metálicos, deberías aprenderte de memoria los casos especiales como: el amoniaco, metano, borano, arsina y estibina.
Nomenclatura Tradicional y Sistema de los Hidruros de No Metal
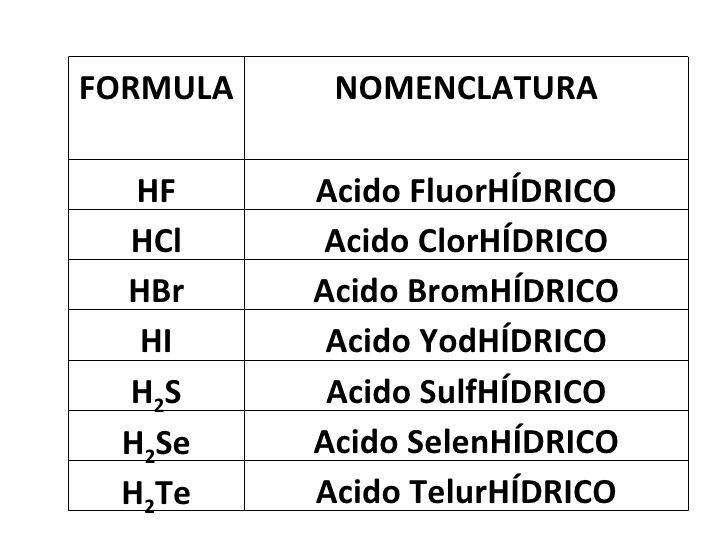
También estúdiate los hidruros no metálicos especiales cuya nomenclatura tradicional en disolución acuosa son ácido clorhídrico, fluorhídrico, sulfhídrico y selenhidrico.
Ejemplos de los Hidruros Ácidos Especiales
Ejercicio Formulación y Nomenclatura de Hidruros
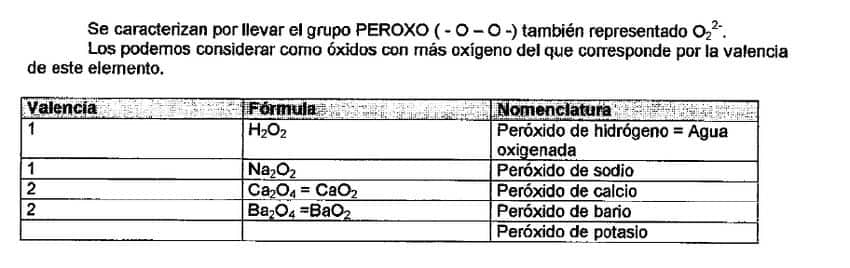
Formulación Inorgánica Peróxidos
No suele ser muy común que los peróxidos entren en los exámenes de selectividad, pero aun así te los voy a explicar por si acaso.
El peróxido más conocido es el agua oxigenada que es peróxido de hidrógeno: H2O2.
Los peróxidos se consiguen al combinar el grupo O2 con un metal. El grupo O2 pasa una valencia 2.
♦ Así por ejemplo:
Na2O2 es peróxido de sodio o peróxido sódico.
♦ En este caso se ve claramente que es un peróxido, pero en casos como en CaO2 te pueden resultar más complicado distinguir si se trata de un oxido o un peróxido. ¿Tú que crees?.
Ejercicios Resueltos de Formulación y Nomenclatura de Peróxidos
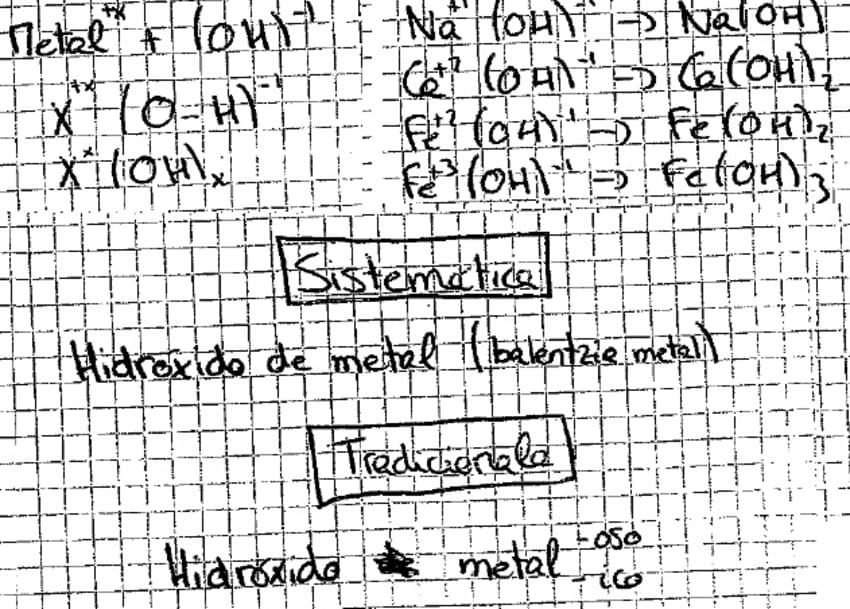
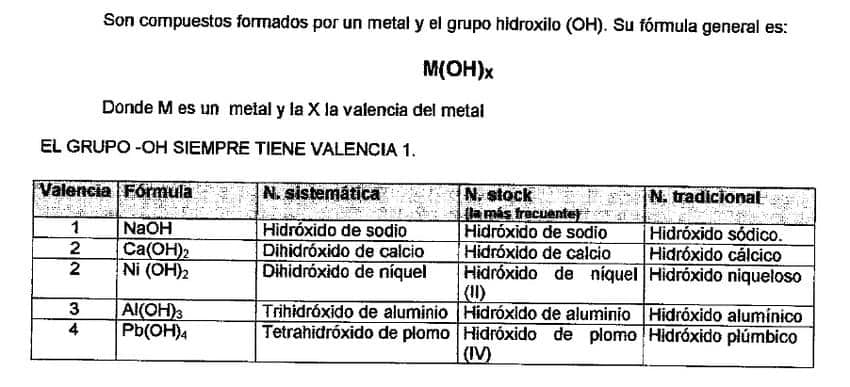
Formulación y Nomenclatura de Hidróxidos
El hidróxido se consigue con la combinación de un metal con el grupo inseparable OH.
Son muy sencillos ya que el grupo OH únicamente pasa la valencia 1.
♦ Como por ejemplo:
- NaOH hidróxido sódico o hidróxido de sodio
- Ca(OH)2 hidróxido de calcio. En este caso el grupo hidróxido se debe poner entre paréntesis.
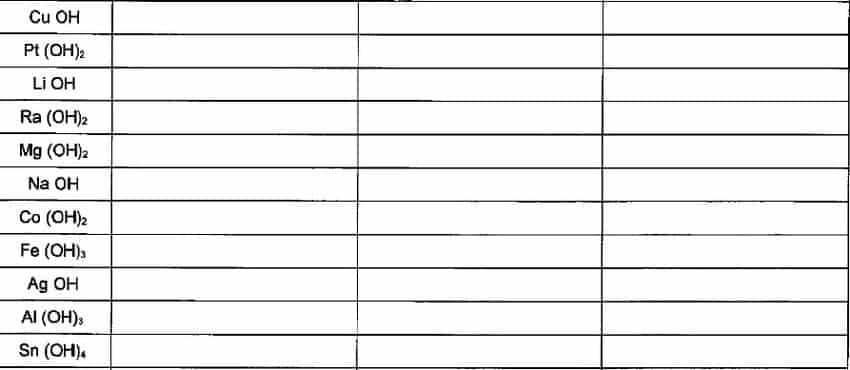
Ejemplos de como Formular y Nombrar Hidróxidos
Ejercicios Formulación y Nomenclatura de Hidróxidos
Formulación Inorgánica Sales neutras
Las sales neutras se consiguen por la combinación de un metal + un no metal
El metal siempre se coloca el primero. Al no metal, que se coloca el último, se le añade la terminación -uro y siempre utiliza su valencia negativa.
Si el último fuera el cloro sería un error pensar que puede pasar 1,3,5 o 7, ya que el cloro como valencia negativa tiene el -1 y es la que pasa. Parece tontería, pero muchos alumnos cometen este error.
Si tienes duda de cuál es la valencia negativa de los no metales, te puede ayudar saber que suele coincidir con la más pequeña.
Es decir:
♦ En el caso del flúor, cloro, bromo, sus valencias son 1,3,5 y 7. La valencia negativa es -1 que es las más pequeña.
♦ En el caso del oxígeno, azufre, selenio sus valencias son 2,4 y 6 su valencia negativa es -2 que también es la más pequeña.
Nomenclatura Ácidos Inorgánicos.
La nomenclatura y formulación de ácidos es muy importante ya que intervienen en muchas reacciones como en las redox y ácido base.
Te recomendaría que te los estudiarás de memoria el nombre y la formula de estos ácidos que suelen aparecen en infinidad de exámenes de selectividad:
- Ácido nítrico HNO3
- Ácido sulfúrico H2SO4
- Ácido carbónico H2CO3
- Ácido fosfórico H3PO4
Para formular un ácido únicamente tienes que hacer el anhídrido y sumarle agua.
Es decir, si te piden formular el ácido nítrico, los pasos a seguir son:
- Formular en anhídrido nítrico: N2O5
- Le sumas agua N2O5 + H20 = H2N2O6
- Simplificas si se puede: en este caso HNO3
Trucos para aprender a nombrar y formular ácidos rápido
Ejemplos Resueltos Nomenclatura Tradicional, Sistemática, Tradicional y de Stock de Ácidos
Ejercicios Química para Formular y Nombrar Ácidos
Dnota10 esta destinado a proporcionar ejercicios y exámenes de química de segundo de bachillerato para aprobar la selectividad de química.
Formulación Ácidos especiales
Los ácidos que contienen los elementos fosforo, arsénico, antimonio, bismuto y boro son especiales, ya que pueden sumar una molécula de agua (como en el caso de los ácidos normales) dos moléculas o tres de agua
Si sumas una molécula de agua los tienes que nombrar en el prefijo meta-. Por ejemplo: ácido meta fosfórico
- Si sumas dos por el prefijo piro- . Ejemplo: ácido pirofosfórico
- Si suman tres con el prefijo orto-. Ejemplo acido orto fosfórico
A consecuencia de esto, el error que cometen muchos alumnos cuando les piden formular el ácido fosfórico es sumarle una molécula de agua, lo cual estaría mal, ya que el ácido fosfórico es el orto fosfórico hay que sumarle tres moléculas de agua.
Ejemplos Resueltos Formulación Ácidos con el fosforo, arsénico y antimonio; META, PIRO, ORTO
Ejercicios para Formular Ácidos Especiales con el Fosforo
Formulas y nombres de ácidos con el Cromo y Manganeso
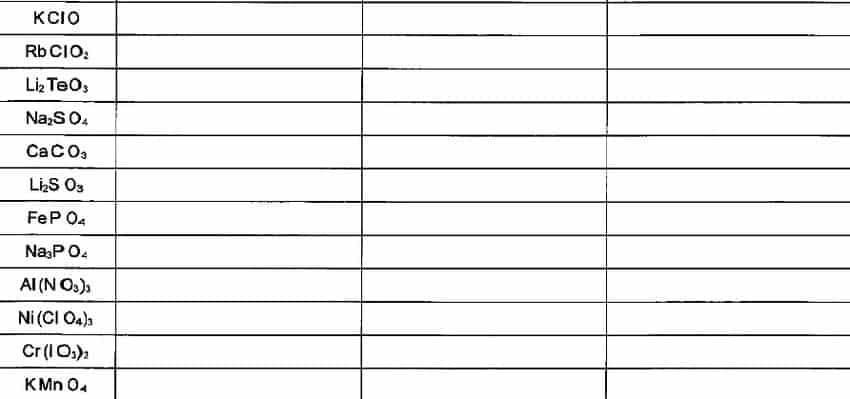
Nomenclatura y Formulación de Sales
Las sales también son muy importantes, así que te recomiendo que las aprendas bien. Sobre todo algunas que aparecen casi siempre en los exámenes de selectividad de química, en el apartado de redox, al menos en el País Vasco:
⇒ Permanganato sódico o potásico: KMnO4. El permanganato es muy importante en la valoraciones redox o permanganimetrias.
⇒ Dicromato sódico o potásico: Na2Cr2O7
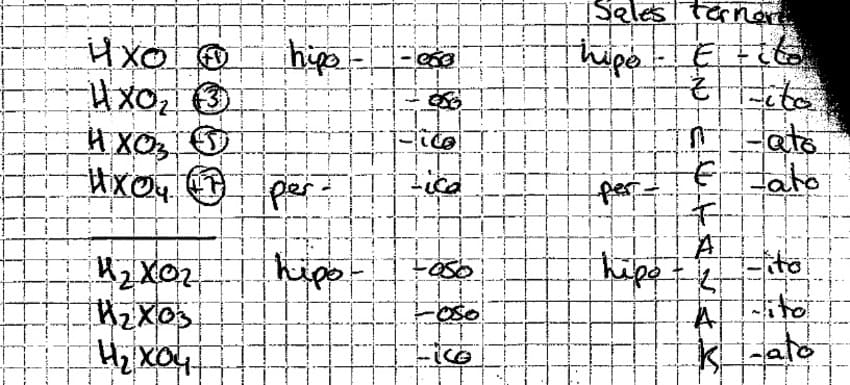
Para formular correctamente una sal tienes que tener formular primero su ácido correspondiente, teniendo en cuenta que:
- Si el ácido termina en ico la sal en ato
- Si el ácido termina en oso la sal en ito
Una vez hayas formulado el ácido, si sustituyes el hidrógeno por el metal con su valencia correspondiente, ya tendrás formulado la sal.
Prefijos y sufijos utilizados para formular y nombras sales acidas
Por ejemplo:
Para formular el sulfato potásico:
- Sulfato viene de sulfúrico, con lo cual primero tienes que formular el ácido sulfúrico.
- Para formular el ácido sulfúrico primero tienes que sacar la formula del anhídrido sulfúrico: SO3.
- Al anhídrido sulfúrico le sumas agua: SO3 + H2O = H2SO4.
- En el lugar del hidrogeno metes el potasio = K2SO4.
Trucos para Formular Sales Dobles
Ejemplos Resueltos de Formular y Nombrar Sales
Ejercicios formulación Inorgánica Sales acidas
Ejercicios Nomenclatura Sales Acidas, Básicas y Neutras
Formulación de Sales Acidas como el Bisulfato
Nomenclatura Inorgánica de Iones
| Concepto de Valencias Iónicas Para Formulación | DESCARGAR PDF |
Dnota10 esta destinado a proporcionar ejercicios y exámenes de química de segundo de bachillerato para aprobar la selectividad de química.