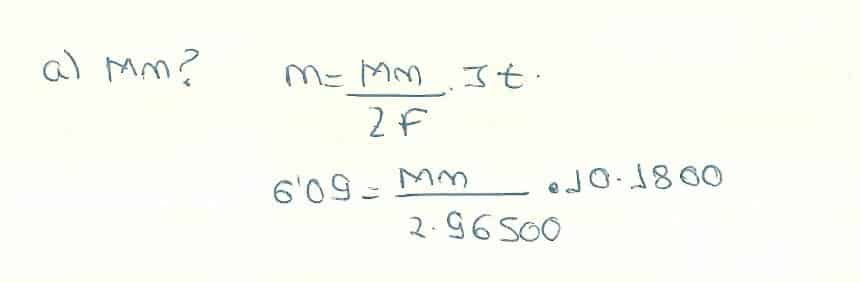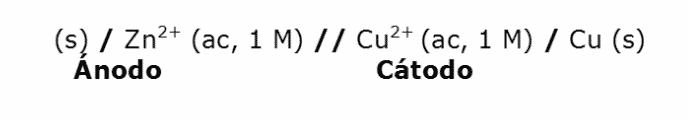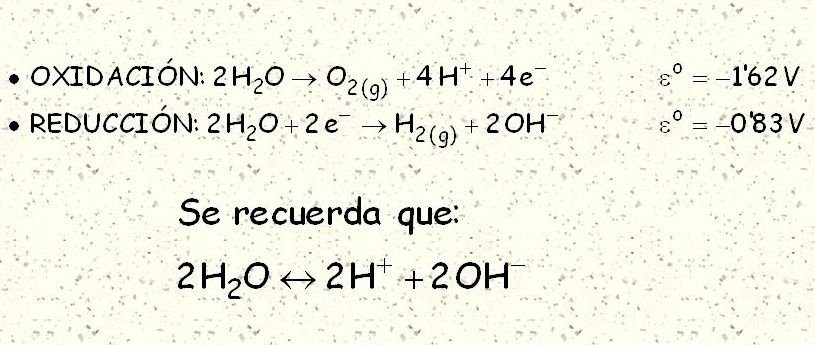Ejercicios de Pilas y Electrolisis [ Exámenes Resueltos ]
Problemas, cuestiones y ejercicios resueltos de Pilas y Electrolisis de Química de 2º de Bachillerato y Preparación para Selectividad.
- Ejercicios de Electrolisis y Pilas Segundo Bachillerato
-
Ejercicios Resueltos Pilas y Electrolisis Bachiller
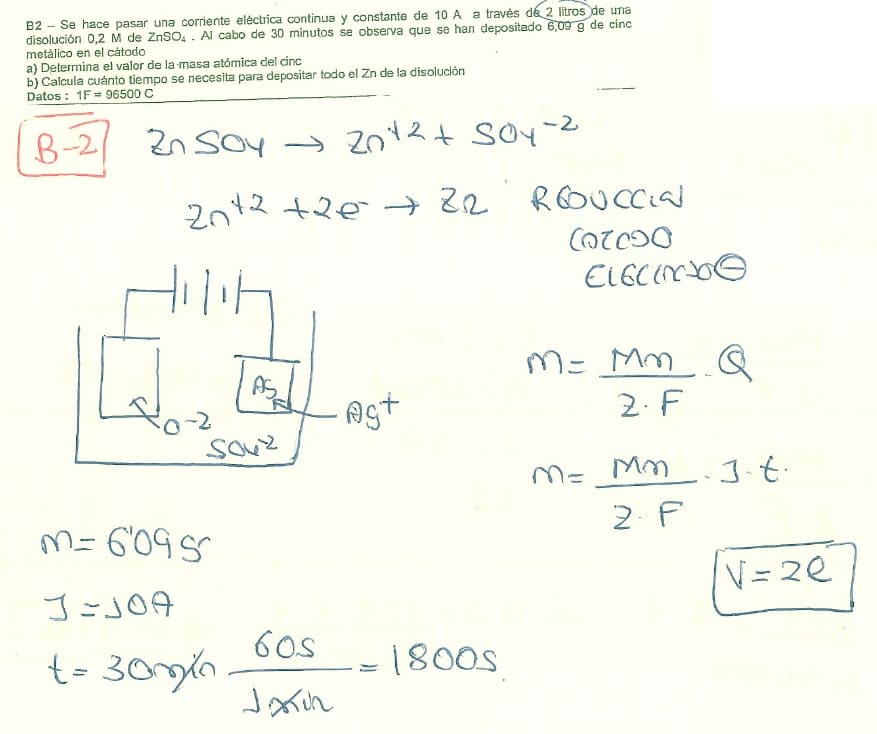
- EJERCICIO 1: Se hace pasar una corriente eléctrica de sulfato de zinc
- EJERCICIO 3: Calcular la masa de níquel y el equivalente en gramos que se deposita en el cátodo cuando se hace pasar una corriente eléctrica de 0,1 Amperios durante 20 horas.
- EJERCICIO 4: Calcular la intensidad de corriente cuando el sulfato de cobre se somete a una electrolisis durante 60 segundos y se deposita una masa de 2,59 gramos en el cátodo.
- EJERCICIO 5: Calcular la masa atómica del cobre en una cuba electrolítica cuando se le hace pasar una corriente eléctrica de 2 amperios durante 1 minuto y se depositan 2, 59 gramos en el catodo.
- Ejercicios y Exámenes en Pdf de Pilas, Electrolisis y Leyes de Faraday
- Resumen de Formulas y Teoría de Pilas
- Resumen de Formulas y Teoría de Electrolisis - Leyes de Faraday
Ejercicios de Electrolisis y Pilas Segundo Bachillerato
Ejercicios Resueltos Pilas y Electrolisis Bachiller
Ejemplos de ejercicios resueltos de electrolisis, masa que se deposita en el cátodo, masa atómica del metal, intensidad de corriente y tiempo.
EJERCICIO 1: Se hace pasar una corriente eléctrica de sulfato de zinc
a) Calcular la masa atómica del Zinc
b) Calcular el tiempo que tarda en depositarse todo el Zinc
EJERCICIO 2: Se pretende platear una barra metálica mediante electrolisis
b) Calcular el tiempo que tarda la corriente eléctrica en depositar una capa de plata de 2 milímetros de espesor
EJERCICIO 3: Calcular la masa de níquel y el equivalente en gramos que se deposita en el cátodo cuando se hace pasar una corriente eléctrica de 0,1 Amperios durante 20 horas.
EJERCICIO 4: Calcular la intensidad de corriente cuando el sulfato de cobre se somete a una electrolisis durante 60 segundos y se deposita una masa de 2,59 gramos en el cátodo.
EJERCICIO 5: Calcular la masa atómica del cobre en una cuba electrolítica cuando se le hace pasar una corriente eléctrica de 2 amperios durante 1 minuto y se depositan 2, 59 gramos en el catodo.
Ejercicios y Exámenes en Pdf de Pilas, Electrolisis y Leyes de Faraday
Todos los ejercicios están en formato pdf para que te los puedas descargar cómodamente.
Es necesario tengas una cuenta gratuita de Google drive.
Por motivos de espacio y velocidad de carga no me ha sido posible subirlos directamente a Dnota10.
| Pilas Problemas Resueltos Selectividad | DESCARGAR PDF |
| Electrolisis Exámenes Resueltos Selectividad | DESCARGAR PDF |
| Leyes de Faraday Exámenes Selectividad | DESCARGAR PDF |
| Potenciales Estándar de Pilas Ejercicios Resueltos | DESCARGAR PDF |
| Formulas de Electrolisis Exámenes Resueltos Selectividad | DESCARGAR PDF |
| Cubas electroliticas Ejercicios Pdf | DESCARGAR PDF |
Resumen de Formulas y Teoría de Pilas
Diferencias entre Pilas y Electrolisis
Básicamente las pilas son lo contrario a la electrolisis. Es decir, las pilas se usan para obtener energía como por ejemplo las pilas para que funcione el mando de la tele.
En la electrolisis, al contrario, tú das energía (le metes una corriente eléctrica) para conseguir que un metal se deposite en una superficie. Por ejemplo, para platear, es decir, dar un baño de plata a una pulsera.
Metiendo una intensidad e corriente, por medio de la electrólisis, conseguimos que el metal plata se deposite sobre la superficie que nos interesa.
¿Cómo funciona una pila?
Una pila funciona por transferencia electrones. Esto está muy unido a las reacciones redox que ya te he explicado.
Si has entendido bien los conceptos en redox, las pilas te van a resultar muy fácil.
Si no te recomiendo que revises las reacciones de oxidación reducción aquí:
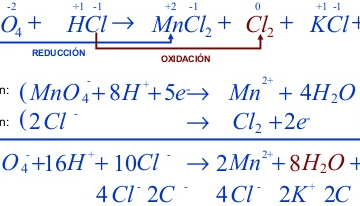
Redox Reacciones de Transferencia de Electrones: Ajuste método Ion-Electrón
Leer Más
Una pila está compuesta por dos semi-reacciones:
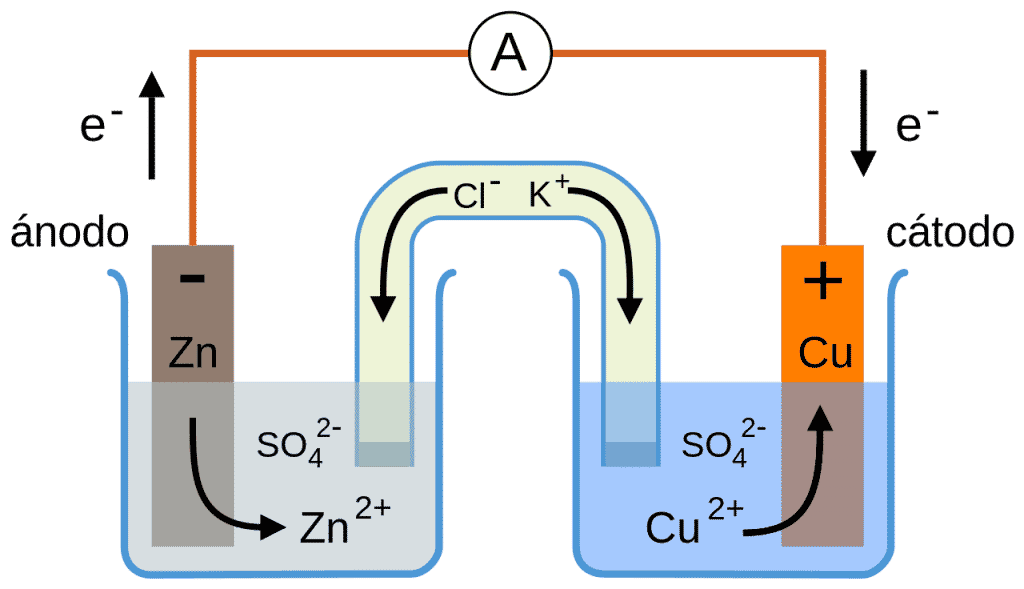
- Una reducción que ocurre en el cátodo que es el electrodo positivo de la pila (cuidado con esto que en la electrolisis cambia).
- Una oxidación que ocurre en el ánodo, que es el electrodo negativo de la pila.
Y es así de sencillo. En la reducción se ganan electrones y en la oxidación se pierde como en redox.
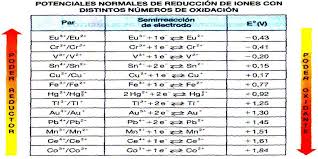
Potenciales de reducción en Pilas
El potencial de reducción es un valor que esta tabulado que te indica la capacidad de reducción de una determinada reacción.
Se toma como cero el potencial estándar de reducción del hidrógeno.
Los potenciales de reducción estándar s miden en voltios (v).
Básicamente lo que tienes que saber, sin tanto rollo, es que la reacción o par redox que tenga el valor del potencial estándar más alto se reduce y el que tenga el potencia más bajo se oxida.
En la práctica, en los ejercicios te dan los datos de los potenciales estándar de reducción.
Este tiene el potencial más grade así que se reduce, es el cátodo de la reacción.
El otro tiene el potencial más pequeño así que se oxida, es el ánodo.
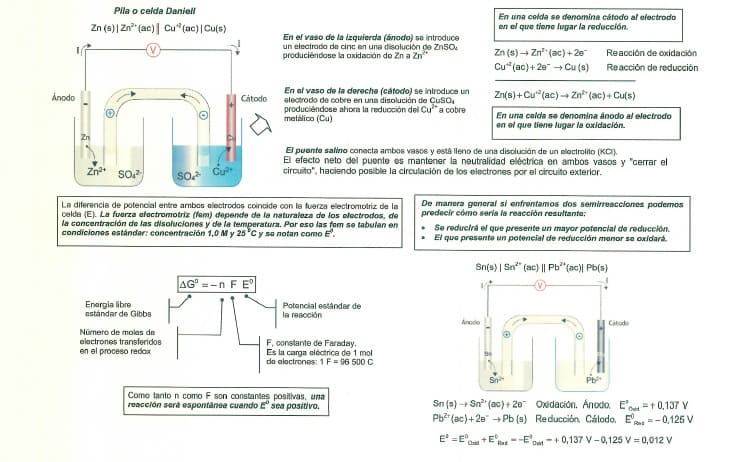
Esto es así porque la fórmula del potencial estándar de una pila es:
Y lógicamente si se monta una pila es para que funcione ⇒ luego el potencial estándar total de la pila tiene que ser positivo ⇒ lo que nos lleva a que el potencial del cátodo tiene que ser mayor que el ánodo.
En caso de que el potencial total estándar de la pila te de negativo eso quiere decir que la reacción es al revés porque, de la manera en la que está formulada la pila, no funcionaria.
Si al hacer un problema el potencia estándar de la pila te da cero eso quiere decir que la reacción está en el equilibrio.
Sino lo recuerdas repasa el tema de equilibrio químico aquí:

Ejercicios Resueltos de Equilibrio Químico Constantes Kc y Kp
Leer Más
Los potenciales que están tabulados son los potenciales estándar (con el cerito, como las entalpias). Te recuerdo que las condiciones estándar no son las normales.
ERROR COMÚN: Las condiciones estándar son T= 298 k P= 1 atm.
Notación estándar de una pila
En algunos ejercicios de selectividad (la verdad que en pocos) te piden que escribas la notación científica de la pila:
♦ A la izquierda se escribe el ánodo (electrodo negativo donde ocurre la oxidación).
♦ A la derecha el cátodo (electrodo positivo de la pila donde ocurre al reducen).
Entre paréntesis se escriben los estados en los que se encuentran los reactivos:
solido, líquidos, gas, aq o ac (disolución acuosa)
y su concentración.
Recuerda que en condiciones estándar la concentración de reactivos y productos es 1 M (molar= mol/l).
Entre medios se escriben dos barras que representan el puente salino.
Lo tienes que escribir en el orden en que se producen las reacciones:
A la izquierda, en el ánodo el zinc solido pasa a ion zinc, lo escribes como ocurre en la semi-reacción, en ese orden.
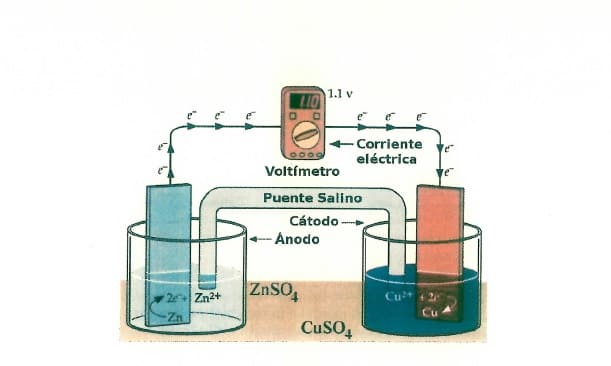
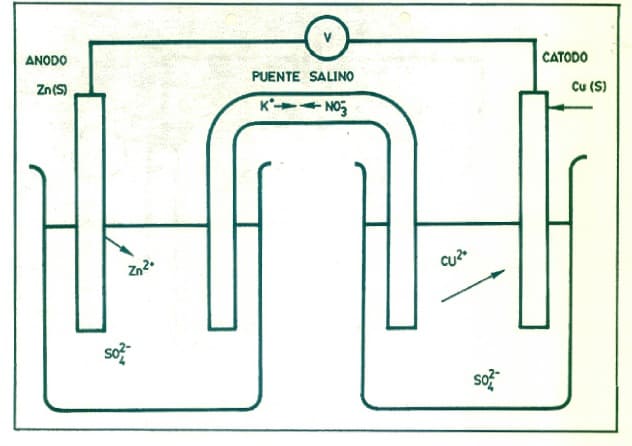
Pila Daniell Zinc y Cobre
Seria conveniente que te estudiarás la pila Daniell de memoria ya que ha caído muchas ves en selectividad, al menos aquí en el País Vasco:
Tanto en las pilas como en las cubas electrolíticas, que te explicaré después, los electrones siempre van del ánodo al cátodo.
Esto es lógico porque el ando se oxida y pierde electrones, y el cátodo se reduce ganando los electrones que ha perdido el ánodo.
Resumen de Formulas y Teoría de Electrolisis - Leyes de Faraday
La electrolisis se desarrolla en una cuba electrolítica y sigue las leyes de Faraday. La electrolisis sirve para depositar un metal como plata u oro en una superficie haciendo pasar una corriente eléctrica.
La electrolisis consiste en una reducción de metales en el cátodo donde se deposita una masa.
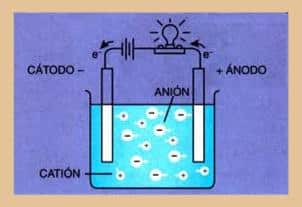
¿Cómo funciona una Cuba Electrolítica?
Una cuba electrolítica es cómo una pila pero con los dos electrodos juntos.
Como ves, la estructura de una celda electrolítica es muy sencilla:
- A la izquierda tenemos el ánodo, al igual que las pilas, excepto que en este caso es el electrodo positivo.
- A la derecha el cátodo, que es el electrodo negativo de la celda electrolítica.
- En el ánodo ocurre la oxidación al igual que en las pilas, es decir, pierde electrones.
- En el cátodo la reducción, gana electrones.
- Los electrones se transfieren del ánodo al cátodo.
En las cubas electrolíticas no hay ni potencial de reducción ni puente salido. Lo cual es lógico porque el puente salido de la pilas servía para conectar los dos electrodos que estaban en recientes distintos, pero en este caso están el mismo recipiente que es la celda electrolítica.
Por lo cual, no necesitan puente salido para conectarlos.
Fórmulas de la electrolisis: Leyes de Faraday
Para calcular la cantidad de masa que se deposita en el cátodo:
- m: es la masa que deposita en el cátodo medida en gramos (g)
- M: es la masa molecular del metal (cobre, hierro, plata, oro, aluminio…) en gramos.
- Q: es la cantidad de carga que pasa a través de la celda electrolica medica en Coulomb (c)
- Z: es el número de electrones que se gana en la reducción (solo en la reducción, no tengas en cuenta la reacción global porque no te la suelen pedir en los exámenes de selectividad)
- F: constante de Faraday que es 96.500 C, dato que estaría bien que te aprendieras de memoria aunque en los examen te lo suelen dar.
El segundo trozo de la fórmula de Faraday se utiliza cuando en lugar de darte la cantidad de carga Q.
Es decir, te dicen que a través de la cuba electrolítica se hace pasar una corriente de no sé cuántos amperios durante una hora, por ejemplo:
- I: intensidad de corriente en amperios (A).
- T: tiempo en segundos. Si te lo dan en horas o en minutos recuerda pasarlo a segundos.
Normalmente la fórmula de Faraday que más se utiliza y te deberías aprender será esta:
Como te he mencionado, en casi todos los exámenes te piden:
- La cantidad de masa que se deposita en el cátodo.
- En otros te dan esa cantidad y te piden la masa molecular del metal como el cobre.
- También te pueden poder la intensidad de corriente que pasa por la celda electrolítica dándote los demás datos, pero eso es cuestión de despejar.
Salvo raras excepciones, lo que interesa es el cátodo, porque es lo que importa en la electrolisis. Para eso se hace, para depositar un metal en una superficie.
Para ambos, cátodo y ánodo, la intensidad de la corriente es la misma, porque están en la misma celda electrolítica.
En el ánodo, las reacciones típicas son en la que un ion de un no metal pasa a gas, como en el caso del ion cloruro que pasa a cloro. (Recuerda ajustar la reacción ya que el cloro es di-molecular).
Si no te dan ningún otro electrodo, supones que lo que se oxida en el ánodo es el agua.
No estaría mal que, por si acaso, te supieras la reacción de oxidación del agua.